2017年6月1日,国际微生物学知名期刊《PLOS Pathogens》在线发表了中国科学院上海巴斯德研究所陈昌斌课题组的最新研究成果Mitochondrial complex I bridges a connection between regulation of carbon flexibility and gastrointestinal commensalism in the human fungal pathogen Candida albicans。研究阐述了人类病原真菌白色念珠菌如何通过线粒体复合物I调控非发酵类碳源代谢促进菌丝生长、生物膜形成以及宿主肠道内共生的新机制。上海巴斯德所陈昌斌研究组研究助理黄新华、硕士研究生陈晓庆和何永明为论文第一作者,陈昌斌研究员为论文通讯作者。
近年来,随着免疫抑制剂、广谱抗生素和皮质类固醇激素的大量使用,导管、插管和器官移植等技术在临床上的广泛开展,以及各种疾病包括艾滋病、恶性肿瘤、恶性血液病、糖尿病和自身免疫病等的日益流行,病原真菌感染的发病率急剧上升,其中白色念珠菌(Candida albicans)感染占主导地位。这种常见的人类条件性致病真菌在健康人群中通常作为共生菌存在于人体粘膜表面(如咽部,胃肠道和泌尿生殖道)而不具有致病性,但是当人体免疫系统受到损害抑制或者正常菌群相互制约作用失调时,白色念珠菌能够从共生菌转变成致病菌,侵染人体几乎所有器官而导致严重的念珠菌病,包括浅度感染(粘膜念珠菌病如鹅口疮、口角炎、阴道炎等)和深度感染(内脏及中枢神经念珠菌病如败血症)。由于白色念珠菌粘附感染的复杂性、多重抗真菌药物耐药性以及抗真菌药物的副作用,治疗这种真菌的感染已经成为临床上的一大难点。在中国白色念珠菌感染占所有真菌感染的81.59%,尽管有抗真菌药物的治疗,念珠菌菌血症的病死率仍高达40%-80%,其中深部白色念珠菌感染病死率为68.9%。正是因为这种高致死率,研发新的预防和治疗白色念珠菌感染的方法成为越来越迫切的任务。而研究白色念珠菌在宿主不同生境(niches)共生定植的分子机制,对于深入了解该菌由不致病的共生菌转化成致病菌的病理发展过程具有重要意义。
与通常实验室培养真菌使用葡萄糖之类的发酵类碳源不同,人体肠道内是一个葡萄糖极其贫乏的环境,肠道内微生物能够获得的碳源主要是非发酵类碳源,比如氨基酸、乳酸、甘油、N-乙酰葡糖胺及甘露醇等。因此,有效吸收利用非发酵类碳源对于白色念珠菌在宿主肠道内定植和共生极为重要,但是相关分子调控机制一直都不清楚。研究人员首次发现了线粒体复合物I 在调控白色念珠菌感知及利用非发酵类碳源甘露醇方面的重要作用。研究结果发现,复合物I中编码泛醌氧化还原酶的亚基(Nuo2)缺失导致该酶催化生成的NAD+水平下降,结果造成NAD+依赖的甘露醇脱氢酶活性被影响而抑制甘露醇向甘露糖的转换。甘露糖介导的糖酵途径关闭导致呼吸链电子传递受阻而产生大量的活性氧(Reactive Oxygen Species;ROS)。ROS生成导致甘露醇特异性的信号传导途径被激活,包括Hog1 MAPK 的磷酸化诱导以及转录因子Brg1表达下调。Brg1表达的下调抑制菌丝特异性基因如HWP1和ALS3等的转录表达,进而严重影响白色念珠菌菌丝生长和生物膜形成。进一步的小鼠体内感染实验发现,线粒体复合物I功能缺失导致白色念珠菌肠道共生能力缺陷,而人为补充发酵类碳源葡萄糖能够显著改善复合物I突变株的肠道定植,充分说明白色念珠菌利用非发酵类碳源的能力对于其在宿主肠道环境的共生定植至关重要,而线粒体复合物I起到了关键的调控作用。
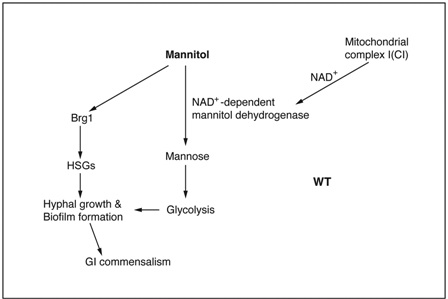
线粒体复合物I通过调控非发酵类碳源利用促进白色念珠菌菌丝生长、生物膜形成以及宿主肠道内共生的分子机制模式图
原文链接:
Mitochondrial complex I bridges a connection between regulation of carbon flexibility and gastrointestinal commensalism in the human fungal pathogen Candida albicans
原文摘要:
Efficient assimilation of alternative carbon sources in glucose-limited host niches is critical for colonization of Candida albicans, a commensal yeast that frequently causes opportunistic infection in human. C. albicans evolved mechanistically to regulate alternative carbon assimilation for the promotion of fungal growth and commensalism in mammalian hosts. However, this highly adaptive mechanism that C. albicans employs to cope with alternative carbon assimilation has yet to be clearly understood. Here we identified a novel role of C.albicans mitochondrial complex I (CI) in regulating assimilation of alternative carbon sources such as mannitol. Our data demonstrate that CI dysfunction by deleting the subunit Nuo2 decreases the level of NAD+, downregulates the NAD+-dependent mannitol dehydrogenase activity, and consequently inhibits hyphal growth and biofilm formation in conditions when the carbon source is mannitol, but not fermentative sugars like glucose. Mannitol-dependent morphogenesis is controlled by a ROS-induced signaling pathway involving Hog1 activation and Brg1 repression. In vivo studies show that nuo2Δ/Δ mutant cells are severely compromised in gastrointestinal colonization and the defect can be rescued by a glucose-rich diet. Thus, our findings unravel a mechanism by which C. albicans regulates carbon flexibility and commensalism. Alternative carbon assimilation might represent a fitness advantage for commensal fungi in successful colonization of host niches.
doi:10.1371/journal.ppat.1006414
作者:陈昌斌 点击:次

